Lumos
Diagnostics, ein Full-Service-Entwicklungsunternehmen für
Point-of-Care-Diagnostik (POC) aus Kalifornien und ehemaliger Ableger
des in Australien ansässigen Unternehmens Planet
Innovation, und RPS
Diagnostics, ein in Florida ansässiger Entwickler, Hersteller und
Vermarkter von POC-Diagnosetests, haben heute ihre Fusion bekannt
gegeben. Das zusammengelegte Unternehmen wird Lumos Diagnostics heißen.
Diese Pressemitteilung enthält multimediale Inhalte. Die vollständige Mitteilung hier ansehen:
https://www.businesswire.com/news/home/20190529006037/de/
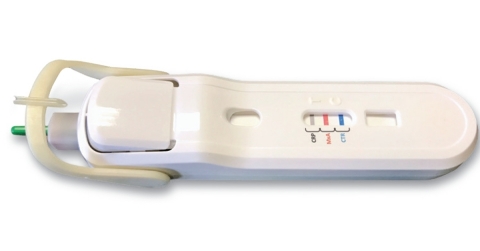
FebriDx Test (Photo: Business Wire)
Zunächst wird sich Lumos Diagnostics auf die internationale Einführung
des FebriDx®-Tests konzentrieren. Dabei handelt es sich um einen
POC-Schnelltest, der in der Arztpraxis durchgeführt werden kann und über
eine integrierte Sicherheitslanzette zur Blutprobenentnahme durch
Fingerpunktion, ein System für rotierende Blutentnahme und Bluttransfer
sowie integrierte Pufferaktivierung per Knopfdruck verfügt. Dieser
ermöglicht Ärzten eine schnelle Bewertung der Immunantwort des Körpers
auf akute Atemwegsinfektionen (AWI). Bei diesem Einwegtest werden
innerhalb von zehn Minuten Patienten ermittelt, die eine klinisch
signifikante Grundinfektion haben. Er hilft bei der Differenzierung
zwischen akuten viralen und bakteriellen AWI durch eine schnelle
Erkennung des Myxovirus-Resistenz-Proteins A (MxA) sowie des C-reaktiven
Proteins (CRP) in peripherem Vollblut. MxA ist ein intrazelluläres
Protein, das bei einer akut auftretenden Virusinfektion erhöht vorkommt,
und CRP ist ein inflammatorisches Akut-Phase-Protein, das beim Auftreten
jeder klinisch signifikanten Infektion erhöht vorkommt.
Sam Lanyon, Vorstandsvorsitzender von Lumos Diagnostics, sagte: „Wir
haben im Laufe der Jahre viele Technologien untersucht und sind zu dem
Schluss gekommen, dass die Kombination der neuartigen
Biomarker-Technologie und der kommerziellen Erfahrung von RPS
Diagnostics mit der auf einem Reader basierenden Plattform von Lumos
Diagnostics eine hoch strategische und synergistische Verbindung ergibt,
die eine robuste Pipeline und kommerziellen Erfolg unterstützen wird.“
Akute AWI sind oftmals hoch ansteckend und machen über die Hälfte aller
Antibiotika aus, die bei Besuchen in Arztpraxen und Notfallambulanzen
verschrieben werden. Akute AWI können mit unspezifischen grippeartigen
Symptomen verknüpft sein, wie z. B. Fieber, Halsschmerzen, Husten,
verstopfte Nase und Müdigkeit. Bakterielle Infektionen haben das höchste
Morbiditätsrisiko und sind die einzigen Infektionen, bei denen eine
Antibiotikabehandlung nützlich ist. Diagnostische Unsicherheit aufgrund
überschneidender Symptome und Anzeichen von AWI sind gemeinsam mit Druck
durch Patienten bzw. deren Eltern auf eine Antibiotikaverschreibung die
Ursache für mehr als 50 Prozent aller unnötigen
Antibiotikaverschreibungen. Einwegschnelltests für den Nachweis von
Erregern, wie z. B. Streptokokkus A und Influenza, können zwischen einer
Kolonisation und einer echten Infektion nicht unterscheiden und sind nur
für spezifische Atemwegserkrankungen indiziert, die bei etwa 15
bzw. 25 Prozent aller untersuchten Patienten festgestellt werden. Die
Mehrzahl der Patienten leidet jedoch an anderen Virusinfektionen,
bakteriellen Infektionen oder mikrobiologisch unbestätigten
Atemwegserkrankungen.
Die klinische Leistung in zwei prospektiven multizentrischen klinischen
Studien aus den USA weist die hohe Genauigkeit des FebriDx-Tests sowie
seinen negativen Vorhersagewert von 97–99 Prozent zum Ausschluss von
bakteriellen Infektionen nach. Darüber hinaus zeigte sich in einer
kleinen Ergebnisstudie in Großbritannien, dass sich mit FebriDx
Entscheidungen bezüglich der klinischen Behandlung bei 48 Prozent der
getesteten Patienten änderten und die Zahl der unnötigen
Antibiotikaverschreibungen um 80 Prozent zurückging. Indem eine
Schnelldiagnose beim ersten Arztbesuch ermöglicht wird, kann der
FebriDx-Test dazu beitragen, die Anzahl unnötiger
Antibiotikaverschreibungen zu begrenzen, die zu vermeidbaren
unerwünschten Reaktionen und Antibiotikaresistenz führen können, was
wiederum zu einer Kostensenkung führt.
Dr. med. Robert Sambursky, Präsident und Chief Executive Officer von RPS
Diagnostics, der in gleicher Position für das zusammengelegte
Unternehmen Lumos Diagnostics weiterarbeiten wird, sagte: „Der Einsatz
von FebriDx zur Triage ambulanter Patienten mit akuten AWI ist
revolutionär, da der erfolgreiche verantwortungsvolle Umgang mit
Antibiotika von Ärzten erfordert, zunächst eine klinisch signifikante
bakterielle Infektion auszuschließen. Darüber hinaus wird der Zugang zur
neuartigen Reader-Technologie von Lumos Diagnostics die nächste
Generation digitaler Verbesserungen vereinfachen, was wiederum zu
schnelleren Resultaten führt, eine Quantifizierung ermöglicht und die
Objektivität unserer Markenproduktlinien verbessert.“
Lumos Diagnostics
Lumos Diagnostics bietet schnelle und kosteneffiziente Lösungen für
komplette Point-of-Care-Diagnostiktests, die urheberrechtlich geschützte
digitale Reader-Plattformen nutzen, um Gesundheitsexperten die genauere
Diagnose und bessere Behandlung von Krankheiten zu ermöglichen. Lumos
bietet Assay-Entwicklung sowie Fertigungsdienste für maßgeschneiderte
POC-Tests an. Darüber hinaus entwickelt, produziert und kommerzialisiert
das Unternehmen direkt eine Reihe von POC-Tests unter der Marke Lumos.
Zu den Krankheiten, die durch Lumos-Tests erkannt werden, zählen
Infektionserkrankungen und Entzündungen, die diagnostisch nicht
ausreichend erschlossen sind, einschließlich Fieber, biologischer
Gefahren und Infektionskrankheiten. Das führt zu weniger unnötigen
Behandlungen und damit einhergehenden unerwünschten Ereignissen,
reduzierter Krankheitsausbreitung und effektiveren Initiativen für den
verantwortungsvollen Umgang mit Antibiotika.
Der FebriDx-Test wurde von Health Canada, der saudischen
Arzneimittelzulassungsbehörde und der Gesundheitsbehörde von Singapur
zugelassen und hat die CE-Kennzeichnung für den Vertrieb in Europa
erhalten. Derzeit hat der FebriDx-Test noch keine Zulassung durch die
US-amerikanische Arzneimittelzulassungsbehörde FDA erhalten und ist in
den USA nicht auf dem Markt erhältlich. Bitte gehen Sie für weitere
Informationen zu Lumos Diagnostics auf lumosdiagnostics.com
und für weitere Informationen zu FebriDx auf febridx.com.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist
die offizielle und autorisierte Version. Übersetzungen werden zur
besseren Verständigung mitgeliefert. Nur die Sprachversion, die im
Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb
Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Originalversion auf businesswire.com ansehen: https://www.businesswire.com/news/home/20190529006037/de/
